A. Definisi
Osteoporosis dicirikan oleh rendahnya massa tulang dan rendahnya kualitas jaringan tulang menyebabkan fragilitas tulang dan peningkatan resiko patah. WHO mengklasifikasikan massa tulang berdasarkan skor T. Skor T adalah jumlah standar deviasi dari rerata kerapatan massa tulang (bone mass density, BMD) untuk populasi normal muda. Massa tulang normal adalah mereka dengan skor T lebih besar dari –1, osteopenia –1 sampai –2,5 dan osteoporosis kurang dari –2,5 (DiPiro, et al., 2006).
Osteoporosis adalah berkurangnya kepadatan tulang yang progresif, sehingga tulang menjadi rapuh dan mudah patah. Tulang terdiri dari mineral-mineral seperti kalsium dan fosfat, sehingga tulang menjadi keras dan padat. Untuk mempertahankan kepadatan tulang, tubuh memerlukan persediaan kalsium dan mineral lainnya yang memadai, dan harus menghasilkan hormon dalam jumlah yang mencukupi (hormon paratiroid, hormon pertumbuhan, kalsitonin, estrogen pada wanita dan testosteron pada pria). Juga persediaan vitamin D yang adekuat, yang diperlukan untuk menyerap kalsium dari makanan dan memasukkan ke dalam tulang. Secara progresif, tulang meningkatkan kepadatannya sampai tercapai kepadatan maksimal (sekitar usia 30 tahun). Setelah itu kepadatan tulang akan berkurang secara perlahan. Jika tubuh tidak mampu mengatur kandungan mineral dalam tulang, maka tulang menjadi kurang padat dan lebih rapuh, sehingga terjadilah osteoporosis (www.medicastore.com, 2009).
Terdapat beberapa jenis osteoporosis, yaitu:
1. Osteoporosis postmenopause (tipe I): Bentuk yang paling sering ditemukan pada wanita kulit putih dan Asia. Bentuk osteoporosis ini disebabkan oleh percepatan resorpsi tulang yang berlebihan dan lama setelah penurunan sekresi estrogen di masa menopause (Dambro, 2006). Terjadi karena kekurangan estrogen (hormon utama pada wanita), yang membantu mengatur pengangkutan kalsium ke dalam tulang pada wanita. Biasanya gejala timbul pada wanita yang berusia di antara 51-75 tahun, tetapi bisa mulai muncul lebih cepat ataupun lebih lambat. Tidak semua wanita memiliki resiko yang sama untuk menderita osteoporosis postmenopause (www.medicastore.com, 2009).
2. Osteoporosis involutional (tipe II) / senilis: Terjadi pada kedua jenis kelamin yang berusia di atas 75 tahun. Tipe ini diakibatkan oleh ketidakseimbangan yang samar dan lama antara kecepatan resorpsi tulang dengan kecepatan pembentukan tulang (Dambro, 2006). Kemungkinan juga diakibatkan dari kekurangan kalsium yang berhubungan dengan usia. Senilis berarti bahwa keadaan ini hanya terjadi pada usia lanjut. Penyakit ini biasanya terjadi pada usia diatas 70 tahun dan 2 kali lebih sering menyerang wanita. Wanita seringkali menderita osteoporosis senilis dan postmenopause (www.medicastore.com, 2009).
3. Osteoporosis idiopatik: Tipe osteoporosis primer jarang yang terjadi pada wanita premenopause dan pada laki-laki yang berusia di bawah 75 tahun. Tipe ini tidak berkaitan dengan penyebab sekunder atau faktor risiko yang mempermudah timbulnya penurunan densitas tulang. Penyebabnya tidak diketahui (Dambro, 2006).
4. Osteoporosis juvenil: Bentuk osteoporosis yang terjadi pada anak-anak prepubertas yang memiliki kadar dan fungsi hormon yang normal, kadar vitamin yang normal dan tidak memiliki penyebab yang jelas dari rapuhnya tulang. Bentuk ini jarang dijumpai (Dambro, 2006).
5. Osteoporosis sekunder: Penurunan densitas tulang yang cukup berat untuk menyebabkan fraktur atraumatik akibat faktor ekstrinsik seperti kelebihan obat-obatan (kortikosteroid, barbiturat, anti-kejang dan hormon tiroid yang berlebihan), artritis reumatoid, kelainan hati/ginjal kronis, sindrom malabsorbsi, mastositosis sistemik, hiperparatiroidisme, hipertiroidisme, varian status hipogonadisme, dan lain-lain (Dambro, 2006). Dialami kurang dari 5% penderita osteoporosis. Penyakit ini bisa disebabkan pemakaian alkohol yang berlebihan dan merokok bisa memperburuk keadaan ini (www.medicastore.com, 2009).
B. Fisiologi-Patofisiologi
Tulang normal terdiri dari komposisi yang kompak dan padat, berbentuk bulat dan batang padat serta terdapat jaringan berongga yang diisi oleh sumsum tulang. Tulang ini merupakan jaringan yang terus berubah secara konstan, dan terus diperbaharui. Jaringan yang tua akan digantikan dengan jaringan tulang yang baru. Proses ini terjadi pada permukaan tulang dan disebut sebagai remodelling. Dalam remodeling ini melibatkan osteoclast sebagai perusak jaringan tulang dan osteoblast sebagai pembentuk sel sel tulang baru.
Menjelang usia tua proses remodeling ini berubah. Aktivitas osteoclast menjadi lebih dominan dibandingkan dengan aktifitas osteoblast sehingga menyebabkan osteoporosis. Separuh perjalanan hidup manusia, tulang yang tua akan diresorpsi dan terbentuk serta bertambahnya pembentukan tulang baru (formasi). Pada saat kanak-kanak dan menjelang dewasa, pembentukan tulang terjadi percepatan dibandingkan dengan proses resorpsi tulang, yang mengakibatkan tulang menjadi lebih besar, berat dan padat. Proses pembentukan tulang ini terus berlanjut dan lebih besar dibandingkan dengan resorpsi tulang sampai mencapai titik puncak massa tulang (peak bone mass), yaitu keadaan tulang sudah mencapai densitas dan kekuatan yang maksimum. Peak bone mass ini tercapai pada umumnya pada usia menjelang 30 tahun. Setelah usia 30 tahun secara perlahan proses resorpsi tulang mulai meningkat dan melebihi proses formasi tulang. Kehilangan massa tulang terjadi sangat cepat pada tahun-tahun pertama masa menopause, osteoporosis-pun berkembang akibat proses resorpsi yang sangat cepat atau proses penggantian terjadi sangat lambat.
Dalam pembentukan massa tulang tersebut tulang akan mengalami perubahan selama kehidupan melalui tiga fase yaitu fase pertumbuhan, fase konsolidasi dan fase involusi. Pada fase pertumbuhan sebanyak 90% dari massa tulang dan akan berakhir pada saat epifise tertutup. Sedangkan pada tahap konsolidasi yang terjadi usia 10-15 tahun. Pada saat ini massa tulang bertambah dan mencapai puncak pada umur tiga puluhan. Serta terdapat dugaan bahwa pada fase involusi massa tulang berkurang ( bone loss ) sebanyak 35-50 tahun.
Aktifitas remodeling tulang ini melibatkan faktor sistemik dan faktor lokal. Faktor sistemik adalah hormonal yang berkainan dengan metabolisme Kalsium, seperti hormon paratiroid, Vitamin D, kalsitonin, estrogen, androgen, hormon pertumbuhan, dan hormon tiroid. Sedangkan faktor lokal adalah Sitokin dan faktor pertumbuhan lain (IGF). (Permana, 2008)
Di samping penuaan dan menopause, penipisan tulang diakibatkan oleh pemberian steroid sehingga mengakibatkan penurunan pembentukan tulang (bone formation) dan peningkatan resorpsi tulang (bone resorption). Steroid menghambat sintesis kolagen tulang oleh osteoblast yang telah ada, dan mencegah transformasi sel-sel prekursor menjadi osteoblast yang dapat berfungsi dengan baik. Di samping itu, steroid juga sangat mereduksi sintesis protein. Gambaran histomorfometrik menunjukkan penurunan tingkat aposisi mineral, dan penipisan dinding tulang, yang diduga karena umur osteoblast yang semakin pendek. Efek steroid terhadap osteoblast juga melalui gangguan atas respons osteoblast terhadap hormon paratiroid, prostaglandin, sitokin, faktor pertumbuhan, dan 1,25-dihidroksi vitamin D. Sintesis dan aktivitas faktor-faktor parakrin lokal mungkin juga terganggu. Dibandingkan proses penuaan, penipisan tulang dalam osteoporosis akibat steroid lebih luas, karena permukaan-permukaan yang mengalami resorpsi dan hambatan formasi tulang juga lebih luas.
Berbeda dengan efek steroid atas pembentukan tulang, penelitian mengenai gangguan resorpsi tulang masih terbatas. Diduga, pengaruh steroid terhadap resorpsi tulang berlangsung melalui hormon paratiroid. Penelitian pada hewan percobaan menunjukkan bahwa setelah pengangkatan kelenjar paratiroid, respons osteoklastik terhadap steroid sepenuhnya hilang, sehingga disimpulkan bahwa resorpsi tulang terutama dikendalikan oleh hormon paratiroid. Namun, kebanyakan penelitian pada manusia tidak menemukan peningkatan kadar hormon paratiroid setelah pemberian terapi steroid. Penelitian lain menemukan peningkatan fragmen-fragmen hormon paratiroid, tetapi kadar hormon yang utuh tidak terpengaruh.
Efek steroid terhadap absorpsi kalsium dalam usus tidak sama di setiap segmen-segmen usus tidak sama. Absorpsi di duodenum lebih kecil, tetapi absorpsi di kolon meningkat. Di samping penurunan absorpsi kalsium, steroid dapat meningkatkan ekskresi kalsium dalam urin. Pada pasien dengan pemberian steroid jangka panjang, hiperkalsiuria kemungkinan besar akibat mobilisasi kalsium di tulang-tulang dan penurunan reabsorpsi kalsium di tubuli renal. Steroid mungkin mengganggu metabolisme vitamin D, walaupun dugaan ini belum didasari bukti kuat. Kadar 1,25 dihidroksi vitamin D dalam serum menurun akibat pemberian steroid, tetapi perubahan dari 25-hidroksi vitamin D menjadi 1,25 dihidroksi vitamin D tidak mengalami perubahan.
Steroid eksogen akan menghambat sekresi gonadotropin dari hipofisis, sehingga fungsi gonad terganggu. Akibatnya, produksi estrogen dan testosteron menurun. Steroid menghambat sekresi LH dan menurunkan produksi estrogen yang difasilitasi oleh FSH. Efek steroid yang lain adalah menurunkan sekresi hormon seks adrenal. Defisiensi estrogen dan pemakaian steroid saling memperkuat efek terhadap laju penipisan tulang. Ketika bone thinning terjadi, bagian trabekular lebih dulu terpengaruh dibandingkan bagian kortikal. Dengan demikian fraktur lebih sering terjadi di tulang-tulang pipih.
Hiperkalsiuria dan bone thinning terjaadi dalam 6 bulan sampai 12 bulan setelah pemakaian steroid eksogen. Setelah itu, laju penipisan tulang melambat hingga 2 sampai 3 kali dibandingkan keadaan normal. Resiko osteoporosis akibat steroid juga meningkat ketika dosis yang diberikan lebih tinggi. Belum jelas, apakah risiko timbul akibat pemberian dosis steroid yang lebih tinggi (prednison > 7,5 mg/dl atau yang setara dan dosis yang dihirup lebih besar dari 800-1200 μg beclomethasone, 800-1000 μg budesonide, 750 μg fluticasone, dan 1000 μg flunisolide) dalam jangka waktu pendek (≤ 6 bulan), atau dosis yang rendah (prednison ≤ 7,5 mg/dl) tetapi dalam waktu lebih lama (> 6 bulan). Yang jelas, risiko osteoporosis meningkat dengan dosis kumulatif steroid lebih tinggi dengan ditandai kehilangan massa tulang yang signifikan. Secara umum, dosis yang rendah lebih aman dibandingkan dosis tinggi, namun tidak jelas berapa dosis yang benar-benar aman. Laju penipisan tulang bisa meningkat hanya dengan pemberian 5-10 mg prednison setiap hari dan juga dengan steroid melalui inhalasi. Pemberian steroid dalam dosis berapapun perlu disertai dengan penilaian risiko osteoporosis dan pemantauan secara terus-menerus untuk mencegah fraktur.
Secara skematis, patofisiologi osteoporosis akibat pemberian steroid dapat digambarkan sebagai 2 proses utama. Proses yang pertama adalah penurunan pembentukan tulang dan kenaikan resorpsi tulang. Terapi steroid secara kronik menurunkan umur osteoblast dan meningkatkan apoptosis. Pemberian steroid juga meningkatkan maturasi dan kegiatan osteoclast dan mengakibatkan antiapoptotik secara langsung. Dengan menurunkan absorpsi kalsium dari usus dan meningkatkan ekskresi kalsium urine, steroid mengakibatkan resoprsi tulang dan hiperparatiroidisme sekunder. Steroid menghambat produksi hormon steroid seksual dan sekresi dari adrenal, ovarium dan testis yang juga mengakibatkan resorpsi tulang (Wachjudi, 2008).
Gambar 2.1 Patofisiologi Osteoporosis Akibat Steroid (Wachjudi, 2008)
C. Gejala
Osteoporosis merupakan silent disease. Penderita osteoporosis umumnya tidak mempunyai keluhan sama sekali sampai orang tersebut mengalami fraktur.
Komplikasi osteoporosis antara lain patah tulang terutama tulang belakang, pangkal paha dan pergelangan tangan. Patah tulang belakang akan mengakibatkan sakit punggung, dan penurunan tinggi badan (bongkok) dan yang paling berat adalah terjadinya saraf terjepit sehingga me-nimbulkan keluhan neurologis. Patah tulang pangkal paha sering kali membawa permasalahan yang besar dan meng-akibatkan terjadinya disabilitas sehingga dalam kehidupannya memerlukan perto-longan orang lain, sedang patah tulang pergelangan tangan sering mengakibatkan deformitas pada tulang tersebut (Wachjudi, 2008).
Kepadatan tulang berkurang secara perlahan (terutama pada penderita osteoporosis senilis), sehingga pada awalnya osteoporosis tidak menimbulkan gejala. Beberapa penderita tidak memiliki gejala. Jika kepadatan tulang sangat berkurang sehingga tulang menjadi kolaps atau hancur, maka akan timbul nyeri tulang dan kelainan bentuk. Kolaps tulang belakang menyebabkan nyeri punggung menahun. Tulang belakang yang rapuh bisa mengalami kolaps secara spontan atau karena cedera ringan. Biasanya nyeri timbul secara tiba-tiba dan dirasakan di daerah tertentu dari punggung, yang akan bertambah nyeri jika penderita berdiri atau berjalan. Jika disentuh, daerah tersebut akan terasa sakit, tetapi biasanya rasa sakit ini akan menghilang secara bertahap setelah beberapa minggu atau beberapa bulan. Jika beberapa tulang belakang hancur, maka akan terbentuk kelengkungan yang abnormal dari tulang belakang (punuk Dowager), yang menyebabkan ketegangan otot dan sakit. Tulang lainnya bisa patah, yang seringkali disebabkan oleh tekanan yang ringan atau karena jatuh.Salah satu patah tulang yang paling serius adalah patah tulang panggul. Hal yang juga sering terjadi adalah patah tulang lengan (radius) di daerah persambungannya dengan pergelangan tangan, yang disebut fraktur Colles. Selain itu, pada penderita osteoporosis, patah tulang cenderung menyembuh secara perlahan (www.medicastore.com, 2009).
D. Diagnosis
Riwayat pasien harus didapatkan untuk mencari riwayat patah tulang sewaktu dewasa, kondisi medis, operasi, dan kehadiran faktor resiko untuk osteoporosis. Faktor resiko genetik termasuk etnis Asia atau Kaukasia, riwayat keluarga untuk osteoporosis atau patah tulang, dan kerangka tubuh yang kecil (tinggi, kurus, indeks massa tubuh kecil). Gaya hidup dan faktor diet termasuk gaya hidup sedentary (banyak duduk) dengan latihan minimal, merokok, penggunaan alkohol berlebih, jarang terkena matahari, asupan kalsium rendah sepanjang hidupnya, intolerasnsi laktosa, asupan kafeine tinggi, asupan protein hewani tinggi, turunnya berat >10% setelah usia 50 tahun, dan anorexia nervosa. Faktor ginekologi termasuk menarche (dimulainya menstruasi) yang terlambat, operasi atau menopause yang lebih cepat, oophorecthomy (pengangkatan ovarium) tanpa terapi penggantian estrogen (estrogen replacement theraphy, ERT), nulliparity, dan amenorrhea. Penyakit kronik yang bisa meningkatkan resiko termasuk hipertiroidisme, sindroma Cushing, kanker tulang dan diabetes melitus. Pengobatan yang meningkatkan resiko termasuk glukokortikoid, penggantian tiroid yang berlebihan, penggunaan heparin dosis tinggi dalam waktu yang lama, dan anti konvulsan.
Pemeriksaan fisik menyeluruh dan analisis laboratorium diperlukan untuk mengetahui penyebab sekunder dan untuk menaksir kifosis dan sakit punggung. Evaluasi biokimia harus memasukkan complete blood count, panel kimia (termasuk koreksi kalsium untuk tingkat serum albumin, fosfor, dan alkalin fosfatase), dan konsentrasi 25-hidroksi vitamin D.
Radiograf sumsum lateral bisa dilakukan pada sakit punggung yang baru atau yang parah untuk mendeteksi patah tulang belakang.
Pengukuran BMD pusat (pinggul dan sumsum) dengan dual-energy x-ray absorptiometry (DXA) adalah standar tertinggi untuk diagnosa osteoporosis. Untuk setiap 1 SD dibawah rerata BMD dewasa muda, resiko patah meningkat dua kali. Pengukuran pada bagian tepi (lengan bawah, tumit, dan phalanges) dengan single-energy x-ray absorptiometry (SXA), ultrasonik, atau DSA hanya digunakan untuk skrining.; prediksi akurat untuk fraktur sudah disediakan oleh BMD pinggul.
Biopsi tulang jarang berguna untuk osteoporosis tapi bisa digunakan untuk mencari sebab sekunder, seperti osteomalasia.
Penanda biokimia untuk turnover tulang digunakan pada uji klinik. Penanda untuk resorpsi tulang termasuk C-terminal atau N-terminal telopeptide dan deoxypyridinolline. Penanda pembentukan tulang termasuk alkaline fosfat spesifik tulang, osteokalsin, dan C-terminal dan N-terminal peptide dengan prokolagen (DiPiro, et al., 2006)
E. Terapi Farmakologi dan Non Farmakologi
Terapi Non Farmakologi
· Diet
- Semua individu dietnya harus seimbang dengan asupan kalsium dan vitamin D yang cukup (tabel 2.1). Tabel 2.2 mencantumkan makanan dengan konsentrasi kalsium tinggi. Jika asupan diet yang cukup tidak bisa dicapai, suplemen kalsium bisa diberikan (DiPiro, et al., 2006).
- Diet penurun berat badan jika penderita mempunyai berat badan yang berlebihan (Dambro, 2006).
- Masukan kalsium 1.500 mg/hari dan semua sumber, jika penderita tidak menderita hiperkalsiuria atau tanpa riwayat baru kalsium. Hasil penelitian menunjukkan penurunan kehilangan massa tulang pada kelompok yang diberi kalsium (Dambro, 2006).
- Hindari masukan fosfat atau protein yang berlebihan, yaitu hindari minuman yang mengandung asam fosfor dan masukan daging yang berlebihan (Dambro, 2006).
· Aktivitas
- Aktivitas jalan-jalan tetap dipertahankan. Penderita dapat melakukan jalan-jalan sepanjang 1 mil dua kali sehari, dan jika mungkin berenang (Dambro, 2006).
- Penderita harus menghindari latihan fisik dan manuver yang meningkatkan gaya kompresif dan stres mekanis pada vertebra dan tempat tulang perifer (Dambro, 2006).
- Prosedur rehabilitasi untuk spasme otot punggung dan dorongan berjalan-ja1an (Dambro, 2006).
Tabel 2.1 Asupan Kalsium dan Vitamin D yang dianjurkan (Phillips, 2008)
Kalsium (mg)
|
Vitamin D (IU)
| ||
Remaja/ anak muda
· Umur 11-24
Pria
· Umur 25-65
· Umur ≥ 65
Wanita
· Umur 25-50
· Umur 51-65 (postmenopause)
- Dengan Estrogen
- Tanpa Estrogen
· Umur ≥ 65
· Hamil dan perawatan
|
1200-1500
1000
1500
1000
1000
1500
1500
1200-1500
|
Umur ≤ 50
Umur 51-70
Umur ≥ 70
Orang dengan resiko tinggi (orang tua,sakit kronis, dipasung)
|
200
400
600
800
|
Tabel 2.2 Makanan Kaya Kalsium (Phillips, 2008)
No.
|
Nama Makanan
|
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
|
1 cangkir susu skim
1 cangkir susu kedelai (+ Kalsium)
1 cangkir yoghurt
1,5 ons keju cheddar
1,5 ons keju jack
1,5 ons keju Swiss
1,5 ons skim mozzarella
4 sdm keju Parmesan parut
8 ons tofu
1 cangkir greens (collards, kale)
2 cangkir brokoli
4 ons almond
2 cangkir keju cottage rendah lemak
3 ons ikan sarden dengan tulang
5 ons ikan salmon kalengan
1 cangkir jus jeruk (+Kalsium)
|
*)Makanan di atas mengandung ± 300 mg kalsium dasar
Terapi Farmakologi
Pengobatan Antiresoptif
1. Kalsium
Kalsium harus diberikan dalam jumlah yang cukup untuk mencegah hipertiroidisme sekunder dan perusakan tulang. Asupan kalsium lebih tinggi telah menunjukkan mencegah atau mengurangi hilangnya massa tulang pada dewasa. Efeknya diperkuat ketika dikombinasikan dengan terapi antiresoptif lain atau latihan fisik. Kombinasi kalsium dan vitamin D menurunkan fraktur vertebral, non-vertebral dan pinggul.
Kalsium karbonat adalah garam pilihan karena mengandung konsentrasi tertinggi kalsium (40%) dan paling murah. Kalsium karbonat sebaiknya diberikan dengan makanan untuk meningkatkan absorpsi dengan peningkatan sekresi asam. Absorpsi kalsium sitrat tergantung asam dan tidak diberikan bersama makanan. Karena fraksi kalsium terabsorbsi menurun dengan peningkatan dosis, dosis terbagi (500-600 mg atau kurang) disarankan.
Efek samping paling umum adalah konstipasi dan flatulen; batu ginjal jarang terjadi (DiPiro, et al., 2006).
2. Diuretik
Thiazide meningkatkan reabsorpsi kalsium urin, tapi meresepkannya tunggal hanya untuk osteoporosis tidak dianjurkan (DiPiro, et al., 2006).
3. Vitamin D dan Metabolit
Defisiensi vitamin D muncul karena asupan yang kurang, kurang terkena sinar matahari, atau penurunan produksi di kulit. Lebih jarang, penurunan sintesis calcitriol di ginjal terjadi karena usia atau disfungsi liver atau ginjal.
Suplemen vitamin D telah menunjukkan meningkatkan BMD, dan bisa mengurangi fraktur.
Kebanyakan tablet multivitamin mengandung 400 IU vitamin D, dan produk kombinasi kalsium-vitamin D mengandung 100-200 IU per dosis. Untuk manula, satu tablet multivitamin sehari (dua tablet sehari untuk yang berusia di atas 70 tahun) cukup untuk asupan vitamin D harian.
Vitamin D dosis tinggi bisa menyebabkan hiperkalsimea dan hiperkalsiuria (DiPiro, et al., 2006).
4. Bifosfonat
Bifosfonat terserap ke apatite (grup kalsium fosfat pada tulang) tulang dan menyatu permanen dengan tulang. Osteoklast tidak mampu menempel pada permukaan tulang yang mengandung bifosfonat. Perkiraan waktu paruh terminal bifosfonat serupa dengan turnover tulang (1-10 tahun).
Alendronate (Fosamax) diindikasikan untuk pencegahan (5 mg/hari) dan perawatan (10 mg.hari) osteoporosis pada wanita postmenopause. Pemberian sekali seminggu (70 mg) memberikan hasil BMD yang serupa, juga mengurangi paparan obat kepada pasien.
Risedronate (Actonel: 5 mg/hari) diindikasikan untuk perawatan dan pencegahan osteoporosis pada wanita postmenopause serta pria dan wanita yang menerima glukokortikoid sistemik (prednisone setara 7,5 mg/hari atau lebih besar) untuk penyakit kronik. Pemberian risendronate sekali seminggu (30-35 mg) masih dalam penyelidikan.
Bifosfonat memberikan peningkatan BMD tertinggi untuk agen antiresorptif. Alendronate, 10 mg.hari, meningkatkan BMD sumsum lumbar 5,4-6%, tulang femoral leher 2,9% dan trochanter (bagian atas tulang femur) 4,4-4,9%. Risedronate, 5 mg/hari, memberikan hasil yang serupa. Peningkatan BMD paling tinggi pada tahun pertama perawatan dan berlanjut selama 7 tahun. Setelah dihentikan, BMD dipertahankan atau menurun perlahan tapi tetap lebih tinggi dari bukan pengguna. Terapi kombinasi dengan estrogen atau terapi penggantian hormon (hormon/estrogen replacement theraphy HRT/ERT) menghasilkan peningkatan BMD yang lebih tinggi daripada pengobatan tunggal. Pengurangan fraktur pada vertebral, non-vertebral dan pinggul telah dibuktikan.
Bifosfonat harus diberikan dengan hati-hati untuk menghindari efek samping saluran cerna yang serius. Semua bifosfonat sulit diabsorbsi (1-5%), dan makanan, minuman, dan kalsium menurunkan absorbsi signifikan. Bifosfonat sebaiknya diberikan pada pagi hari 30-120 menit sebelum pemberian makanan, minuman atau obat pertama dengan segelas penuh air (bukan kopi, jus, air mineral, atau susu). Pasien harus tetap dalam posisi tegak selama 30 menit untuk mencegah iritasi esophageal dan ulserasi. Kalsium dan, jika dibutuhkan, vitamin D sebaiknya juga diberikan tapi pada waktu yang berbeda.
Efek samping paling umum untuk bifosfonat adalah nausea; rasa sakit pada abdominal; dispepsia; diare; dan iritasi, perforasi, ulserasi atau perdarahan esophageal, lambung atau duodenal (DiPiro, et al., 2006).
5. Estrogen dan Terapi Hormon
Estrogen menurunkan aktivitas dan recruitment osteoklast menginhibisi parathyroid hormone (PTH), meningkatkan konsentrasi calcitriol dan absorbsi kalsium intestinal, dan menurunkan ekskresi kalsium ginjal.
ERT dan kombinasi terapi penggantian estrogen-progestin meningkatkan BMD, tapi datanya kurang untuk pencegahan fraktur. Peningkatan BMD kebanyakan terlihat pada tahun pertama perawatan, dengan sedikit peningkatan atau plato setelahnya. Progestin yang ditambahkan ke ERT tidak memberikan perubahan atau sedikit meningkatkan BMD. Estrogen oral dan transdermal pada dosis yang sama dan berlanjut atau siklus ERT/HRT mempunyai efek BMD yang serupa. Efek pada BMD adalah meningkat ketika ERT/HRT dikombinasikan dengan alendronate. Percepatan hilangnya massa tulang terjadi dengan penghentian ERT/HRT. Agen ini telah disetujui oleh FDA untuk pencegahan osteoporosis tapi bukan untuk perawatan.
Karena bukti yang bertentangan mengenai penggunaan ERT/HRT untuk pencegahan penyakit kardiovaskular dan potensi terjadinya kaker payudara tergantung-estrogen, penggunaan ERT/HRT untuk pencegahan dan perawatan osteoporosis berlanjut dalam kontroversi.
ERT/HRT menurunkan fraktur vertebral dan non-vertebral secara signifikan pada beberapa ujicoba pada tidak di uji coba lain. Efek bervariasi oleh tipe tulang, usia pasien, onset terapi, dan durasi ERT. Proteksi dikurangi setelah HRT telah dihentikan selama paling tidak 5 tahun.
Dosis harian ERT yang disarankan untuk pencegahan osteoporosis adalah conjugated equine estrogen 0,625 mg, ethinyl estradiol 0,02 mg, estropipate 0,625 mg, esterified estrogen 0,625 mg, micronized estradiol 1 mg, 17-β-estradiol 2 mg, estrone sulfat 1,5 mg, dan estradiol transdermal 0,05 mg/hari.
ERT biasanya diberikan berkelanjutan dengan pemberian berkelanjutan atau siklus progestin. HRT berkelanjutan paling umum digunakan karena 60-80% wanita akan mengalami amenorrheic dalam 6-12 bulan setelah memulai terapi dan lebih sedikit wanita yang mengalami endometrial hiperplasia. Sampai waktu itu, perdarahan bisa terjadi tanpa terdeteksi. Jika amenorrhea tidak terjadi setelah 10-12 bulan, pola perdarahan yang bisa diprediksi dengan terapi siklus lebih disukai.
Pemberian ERT tunggal berkelanjutan untuk wanita yang sudah mendapat hysterectomy (pengangkatan uterus). ERT meningkatkan resiko endometrial karsinoma pada wanita dengan uterus yang intact (belum rusak). Terapi progestin untuk palin tidak 12-14 hari sebulan biasanya menghilangkan resiko ini dan bahkan bisa protektif. Conterone medroxyprogesterone acetate 2,5-5 mg, micronized progesterone 100 mg per hari, norethindrone acetate 5-10 mg selama 12-14 hari setiap bulan bisa digunakan. Pemberian harian meningkatkan adherence dan merangsang amenorrhea.
Nilai resiko relatif untuk kanker payudara pada wanita yang menjalani ERT/HRT antara 1,1-1,5, dengan resiko sedikit meningkat dengan terapi lebih lama ( paling tidak 5-20 tahun) dan penambahan progestin.
Efek samping dari HRT termasuk perdarahan vagina, melunaknya payudara, migrain, perubahan mood, cholelithiasis (membentuk batu kandung empedu), dan tromboemboli vena.
Kontraindikasi untuk ERT/HRT termasuk kanker aktif atau dicurigai tergantung estrogen, perdarahan vagina abnormal, penyakit liver yang parah, dan trombosis vaskular aktif. Kontraindikasi relatif termasuk migrain, riwayat pemyakit tromboemboli (terutama dengan kehamilan atau setelah penggunaan kontrasepsi oral), hipergliceridemia, fibroid uterine, endometriosis, penyakit kandung empedu, riwayat keluarga untuk kanker payudara, dan disfungsi hepatik kronik (DiPiro, et al., 2006).
6. Selective Estrogen Modulator (SERM)
Ralofexine (Evista) 60 mg sehari diterima untuk pencegahan dan perawatan osteoporosis postmenopause. BMD pinggul dan spinal meningkat dari 2-3 % dan menurunkan fraktur vertebral tapi belum dibuktikan menurunkan fraktur pinggul. Ini pilihan yang baik untuk wanita yang tidak bisa atau tidak boleh menerima estrogen. Bifosfonat mungkin merupakan pilihan yang lebih baik pada osteoprosis parah ketika reduksi resiko fraktur diinginkan.
Ralofexine merupakan antagonis estrogen di jaringan uterine dan payudara sehingga tidak meningkatkan resiko endometrial carcinoma, seperti pada estrogen dan tamoxifen.
Ralofexine dihubungkan dengan peningkatan resiko tiga kali lipat trombemboli vena, serupa dengan resiko pada estrogen. Ralofexine dikontraindikasikan pada wanita dengan penyakit tromboemboli aktif. Efek samping lain termasuk kaki kaku (DiPiro, et al., 2006).
7. Testosteron dan Anabolik Steroid
Metil testosteron (1,25 atau 2,5 mg) dan testosteron yang ditanam (50 mg tiap 3 bulan) dan patch transdermal terkadang diberikan bersama dengan ERT/HRT pada wanita dengan depresi atau libido yang menurun, fungsi seksual, atau tingkat energi setelah oophorectomy (pengangkatan ovarium). Terapi bersama umumnya memberikan efek BMD yang lebih bak daripada ERT tunggal.
Meski anabolik steroid merangsang aktivitas osteoblast, efek predominannya adalah mengurangi resorpsi tulang, yang mungkin sekunder setelah peningkatan massa otot dan kekuatan. Perubahan BMD relatif kecil, dan kebanyakan wanita mendapat efek samping (efek virilizing seperti hirsutisme, jerawat, dan suara yang berat). (DiPiro, et al., 2006)
8. Calcitonin
Semprotan nasal Calcitonin (Mialcacin) diindikasikan untuk perawatan osteoporosis untuk wanta paling tidak 5 tahun setelah menopause. Karena kurang efektif jika dibandingkan dengan pengobatan osteporosis lainnya, calcitonin lebih sering digunakan untuk pasien dengan rasa sakit akibat fraktur atau untuk mereka yang tidak sesuai dengan terapi lainnya.
Regimen 200 IU calcitonin nasal meningkatkan BMD spinal dan mengurangi fraktur vertebral baru sebesar 36%. BMD pinggul tidak selalu dipengaruhi dan tidak menurunkan fraktur pinggul.
Calcitonin salmon digunakan secara klinik karena lebih poten dan efeknya lebih lama daripada calcitonin mamalia. Dosis intranasalnya 200 IU sehari, bergantian di tiap nares (lubang hidung). Pemberian subkutan (injeksi Miacalcin) 100 IU/hari tersedia tapi jarang digunakan.
Calcitonin nasal bisa menyebabkan rhinitis, epistaksis, dan iritasi nasal. Pemberian subkutan bisa menyebabkan simtom saluran cerna, rasa sakit di tempat injeksi, dan wajah memerah (DiPiro, et al., 2006).
Terapi Pembentukan Tulang Investagisional
1. Hormon paratiroid
Meski PTH bisa meningkatkan resportion tulang, PTH (1-84) dan fragmen N-terminalnya (1-34) (teriparatide, masih dalam penyelidikan ketika tulisan ini dibuat) adalah anabolik jika digunakan sekali sehari. Aktivitas anabolik bisa timbul dari menurunnya apoptosis osteoblas dan peningkatan pembentukan tulang dari osteoblas yang hidup lebih lama.
Pada uji klinik fase III kontrol-plasebo pada 1637 wanita postmenopause yang sudah mengalami fraktur vertebral, 14% yang menerima plasebo mendapatkan fraktur vertebral baru jika dibandingkan 5% dan 4% yang menerima teriparatide subkutan 20 dan 40 μg sehari. BMD juga naik pada spinal lumbar dan femur lebih tinggi pada pasien yang menerima dua dosis teriparatide. Efek samping minor (nausea dan sakit kepala) tapi terjadi lebh sering dengan naiknya dosis (DiPiro, et al., 2006).
2. Fluorida
Fluorida meningkatkan aktivitas osteblas dan pembentukan tulang. Tetapi, meski dengan studi bertahun-tahun, efek anti fraktur dari fluoridse masih diragukan, dan fluoride bisa meningkatkan kerapuhan tulang.
Pada satu studi, pria dan wanita yang diberikan fluoride monofosfat dan wanita yang menerima dosis kecil lepas lambat natrium fluoride mengalami fraktur vertebral yang lebih sedikit. Tetapi, hasil ini belum divalidasi pada studi lain. Fluoride saat ini tidak direkomendasikan untuk terapi, tapi produk lepas lambat sedang diuji oleh FDA (DiPiro, et al., 2006).
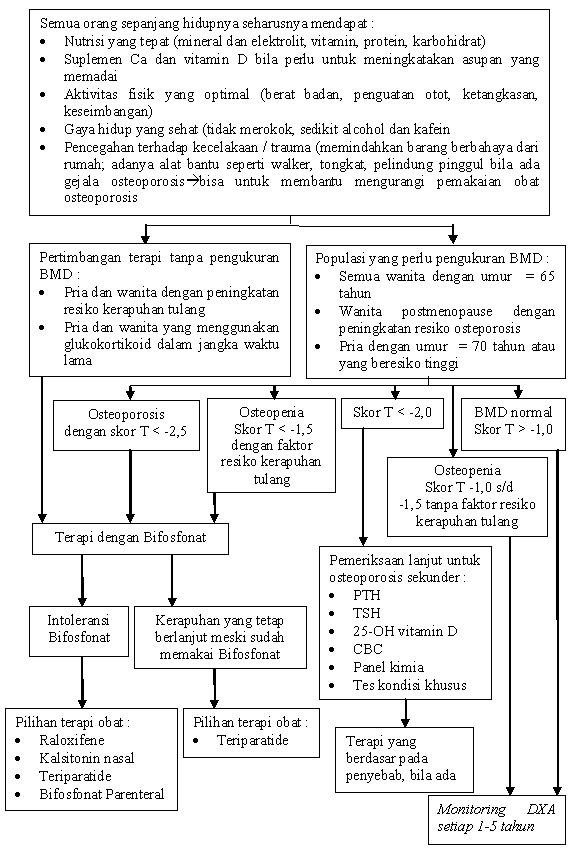
Untuk lebih jelasnya bisa dilihat pada algoritma pecegahan osteoporosis di bawah ini :
Gambar 2.4 Algoritma Pencegahan Osteoporosis (Phillips, 2008)
DAFTAR PUSTAKA
Cipolle, R. J., L.M. Strand, and P. C. Morley, 2007. Pharmaceutical Care Practice, The Clinician’s Guide. 2nd edition. New York. Mc Graw Hill Medical
Dambro, M. R., 2006. Osteoporosis, in : Griffith’s 5- Minutes Clinical Consult. M. R. Dambro (Eds). Philadelphia. Lippincott Williams & Wilkins
Dipiro, J. T., Robert L. T., Gary C. Y., Gary R. M., Barbara G. W., and L. Michael Posey. 2006. Pharmacotherapy A Pathophysiologic Approach. Seventh edition. New York. Mc Graw Hill Medical
ISFI (ikatan Sajana Farmasi Indonesia), 2005. ISO: Informasi Spesialite Obat volume 40- 2005. Jakarta. PT. Anem Kosong Anem (AKA)
Medicastore. 2009. Osteporosis. www.medicastore.com, diakses tanggal 23 November 2009
Permana, H., 2008. Patomekanisme Osteoporosis Sekunder Akibat Steroid dan Kondisi Lainnya. Fakultas Kedokteran Universitas Padjajaran Bandung
Phillips, B. B., 2008. Osteoporosis, in : Pharmacotherapy A Pathophysiologic Approach, 7th edition. J. T. DiPiro, et. al.(Eds). New York. Mc Graw Hill Medical. pp. 853-866
Product Information Flamar® emulgel, diakses tanggal 24 November 2009
Product Information Ossopan®, diakses pada tanggal 24 November 2009
Wachjudi, R. G., 2008. Osteoporosis Akibat Pemakaian Steroid. Fakultas Kedokteran Universitas Padjajaran Bandung